イオン化傾向は水溶液中における水和イオンと単体金属との間の 標準電極電位 の順であらわされる。 このとき水和金属イオンは無限希釈状態である仮想的な1 mol/kgの 理想溶液 状態を基準とし、その標準酸化還元電位と水和金属イオンの標準生成ギブス 自由エネルギー 変化とは以下の関係がある。 ここで F は ファラデー定数 、 z はイオンの電荷である。 金属のイオン化傾向を大きいものから順に配列すると以下のとおりになる(個別に脚注のない金属の電位は『化学便覧 基礎編 改訂4版』 [1] による)。 ただし( )内はギブス自由エネルギー変化からの計算値( [2] による数値)。. 覚え方は、次のように覚えたら良いだろう。 リッチ(Li)に貸(K)そうか(Ca)な(Na)ま(Mg)ぁ(Al)あ(Zn)て(Fe)に(Ni)すん(Sn)な(Pb)ひど(H 2 ) す(Hg) ぎ(Ag) るしゃっ(Pt) きん(Au)
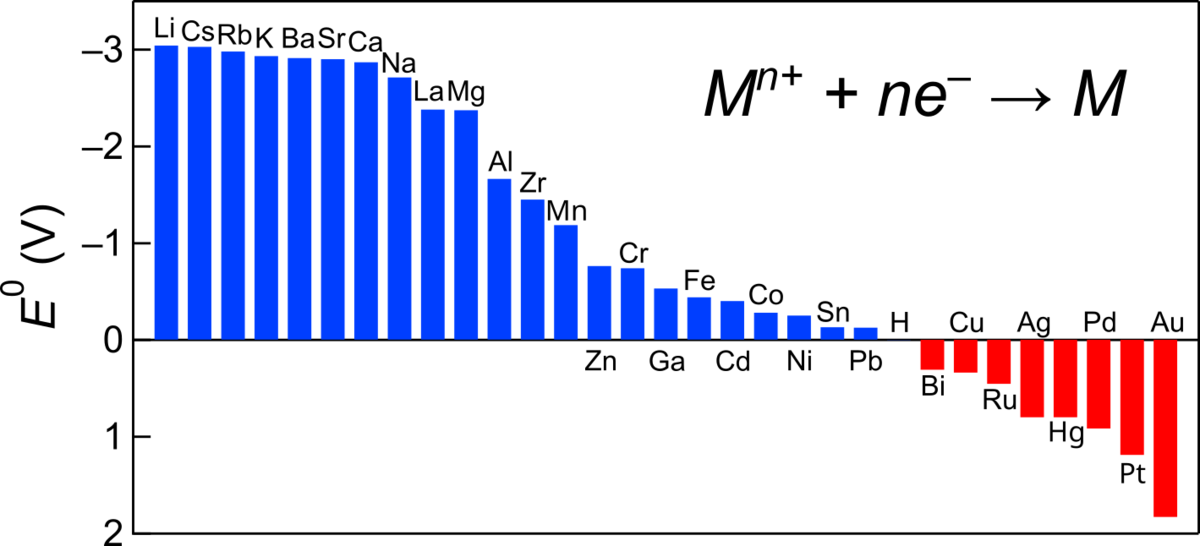
イオン化傾向と標準電極電位:イオンになりやすさの順番 はじめよう固体の科学
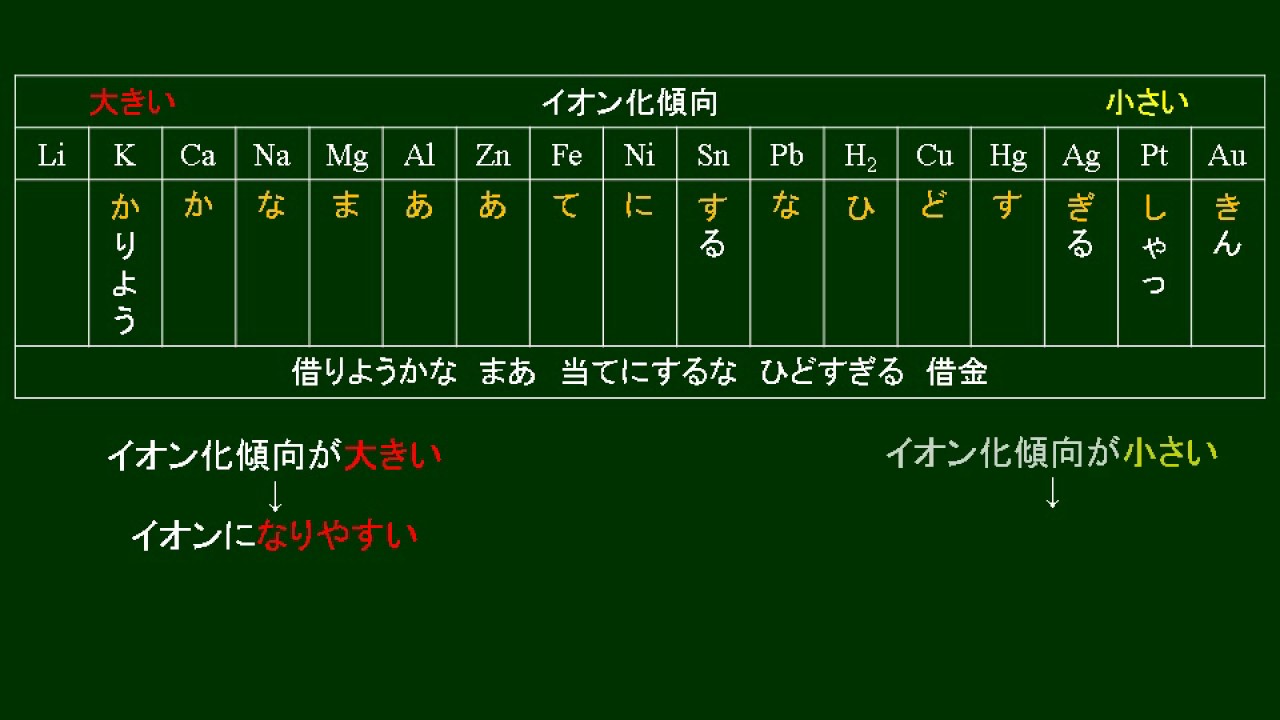
化学基礎 金属のイオン化傾向 YouTube

入試に必要な化学式とイオン式を最速で覚える方法

中3理科「金属のイオン化傾向の覚え方」化学電池のしくみ Pikuu
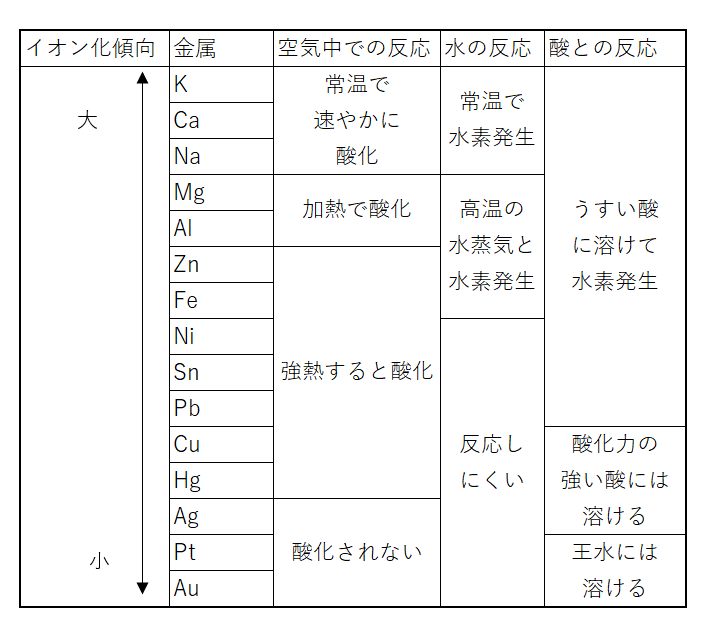
金属のイオン化傾向 大学受験模試プロジェクト【模試プロ】

金属のイオン化傾向実験セット IO5N

【改訂版 金属と水の反応性の覚え方】イオン化傾向と金属の反応性 Mgマグネシウムと熱水の反応 Al, Zn, Fe と水蒸気の反応 酸化還元 無機化学 ゴロ化学基礎・化学 YouTube

脱亜鉛腐食について|配管部品専門店のダンドリープロ
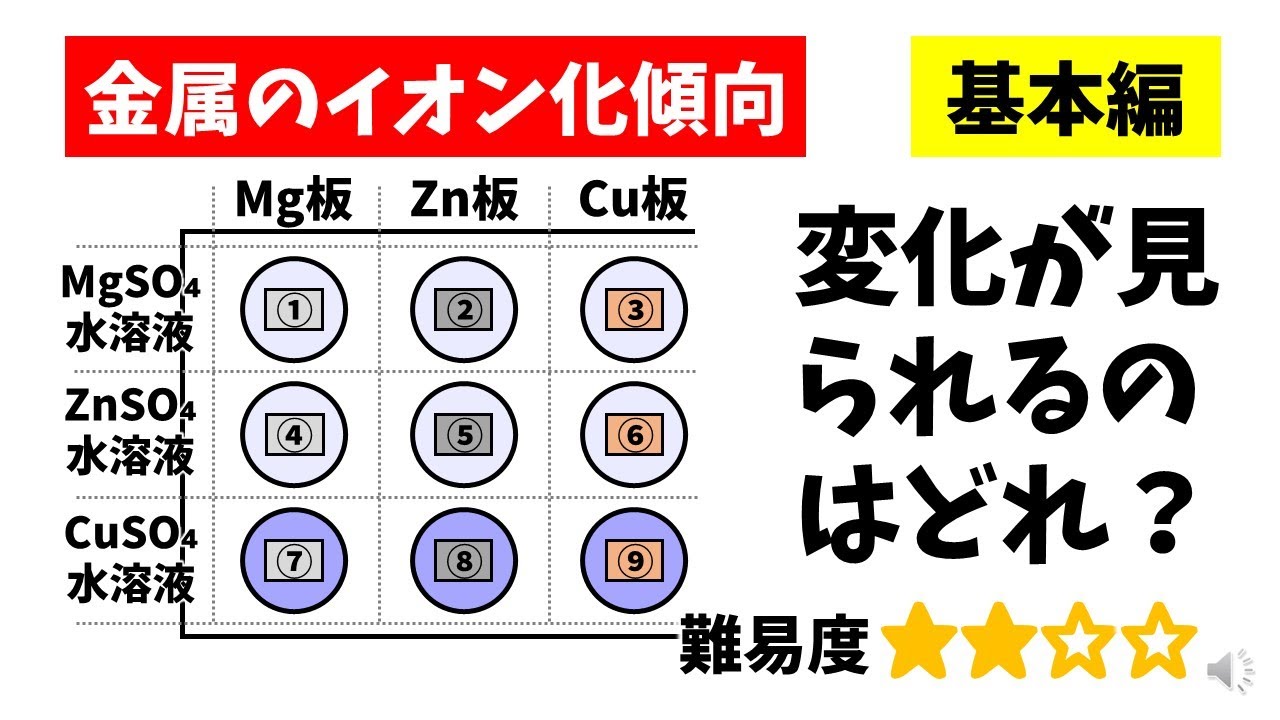
中学理科「金属のイオン化傾向」変化が見られる金属板は? YouTube

【中学理科】金属のイオン化傾向 デルココ

イオン化傾向、語呂合わせ YouTube

イオン化傾向(覚え方・定義・金属板の反応のしやすさ) 化学のグルメ

【高校化学基礎】「金属のイオン化傾向とは」 映像授業のTry IT (トライイット)

【化学基礎】イオン化傾向とは何なのかを徹底解説!語呂合わせと使い方もご紹介 化学の偏差値が10アップするブログ

金属アレルギー あすぷろ実行委員会

【中3理科】金属のイオンへのなりやすさ(イオン化傾向の実験) Examee

イオン化傾向の覚え方とは?語呂合わせや金属の反応性について解説!|高校生向け受験応援メディア「受験のミカタ」

【高校化学基礎】「金属のイオン化傾向」(練習編) 映像授業のTry IT (トライイット)
中3理科「金属のイオン化傾向の覚え方」化学電池のしくみ Pikuu

〔高校化学・酸化還元〕金属のイオン化傾向 -オンライン無料塾「ターンナップ」- YouTube
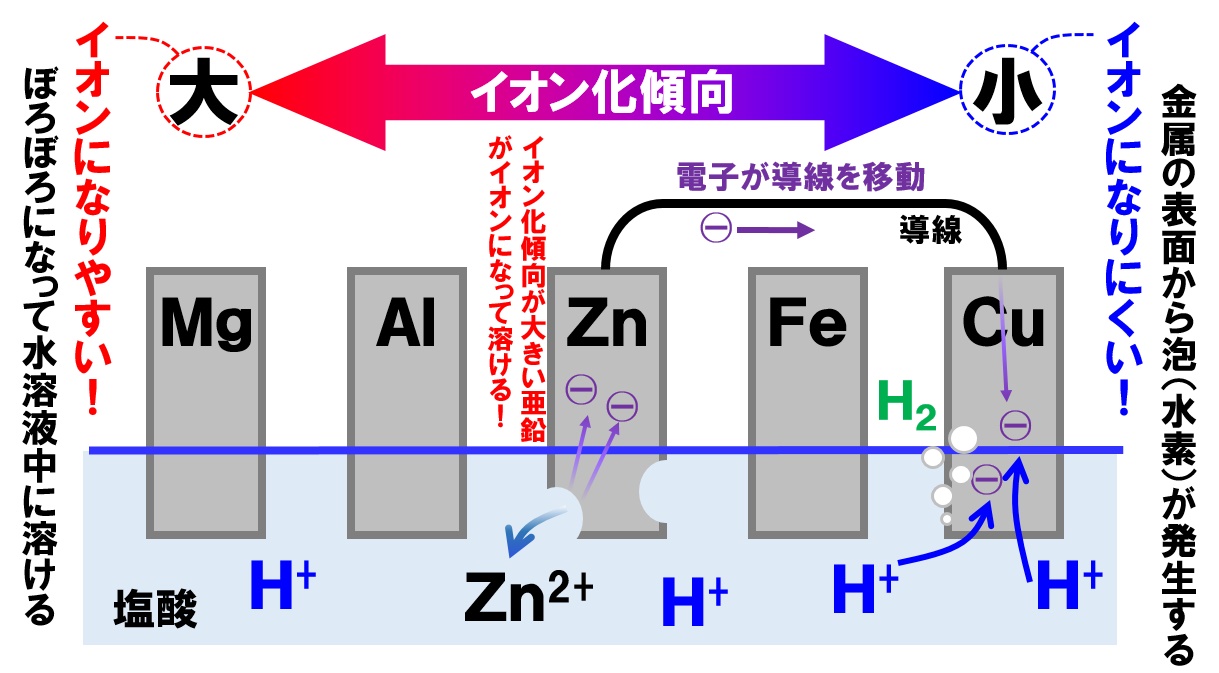
金属の単体が水または水溶液中で電子を放出して陽イオンになろうとする性質を金属の イオン化傾向 といいます。 例えば、希塩酸( HCl )に亜鉛( Zn )を入れると亜鉛は水素( H2 ↑ )を発生しながら溶けます。 これは亜鉛が電子を放出して亜鉛イオン( Zn2+ )となり、 水素イオン( H+ )が電子を受け取って気体の水素( H2 ↑ )になったためです。 反応式では、 Zn +2H+ → Zn2+ + H2 ↑. と表せます。 ところが、 希塩酸に銅や銀を入れても水素は発生しません 。 これは銅や銀が水素よりもイオンになりにくいことを意味しています。 このように金属によって陽イオンになる傾向が違うのです。. 2.1 ①水との反応. 2.2 ②酸素との反応. 2.3 ③酸との反応. 3 単体の製法. 4 まとめ. イオン化傾向とは、 「 金属の陽イオンへのなりやすさ 」 のことを指します。 陽イオンになりやすいというのを言い換えれば、 電子を渡したがっているということですから、 「還元性」が強いということですね。 つまりイオン化傾向が大きいほど反応性が高いということです。 まずはイオン化傾向を並べてみましょう。 このようにイオン化傾向順に並べたものを. 「 イオン化列 」と呼びます。 まずはとにかくこのイオン化列を覚えましょう。 イオン化列の覚え方には有名な語呂合わせがあります。 語呂合わせを覚えた上で何度か紙に書き出し、 確実に覚えるようにしましょう。